上海金畔生物科技有限公司代理AAT Bioquest荧光染料全线产品,欢迎访问AAT Bioquest荧光染料官网了解更多信息。
Amplite 荧光法谷胱甘肽GSH/GSSG比率快速检测试剂盒 绿色荧光
 |
货号 | 10060 | 存储条件 | 在零下15度以下保存, 避免光照 |
| 规格 | 200 Tests | 价格 | 3924 | |
| Ex (nm) | 510 | Em (nm) | 524 | |
| 分子量 | 溶剂 | |||
| 产品详细介绍 | ||||
简要概述
谷胱甘肽是一种含有L-半胱氨酸,L-谷氨酸和甘氨酸的三肽。它是细胞中最小的细胞内蛋白质硫醇分子,可防止由活性氧如自由基和过氧化物引起的细胞损伤。谷胱甘肽以还原(GSH)和氧化(GSSG)状态存在。还原型谷胱甘肽(GSH)是一种主要的组织抗氧化剂,其为谷胱甘肽过氧化物酶(GPx)催化的脂质氢过氧化物还原为其相应的醇和过氧化氢还原为水提供还原当量。在GPx催化反应中,两个GSH分子之间形成二硫键产生氧化型谷胱甘肽(GSSG)。谷胱甘肽还原酶(GR)将GSSG再循环到GSH,同时氧化β-烟酰胺腺嘌呤二核苷酸磷酸(β-NADPH2)。在健康细胞中,超过90%的谷胱甘肽总量为还原型(GSH)。当细胞暴露于增加的氧化应激水平时,GSSG积累并且GSSG与GSH的比例增加。 GSSG-GSH比例增加是氧化应激的指标。监测生物样品中还原和氧化的GSH对于评估细胞和组织对氧化和自由基介导的细胞损伤的氧化还原和解毒状态是必不可少的。
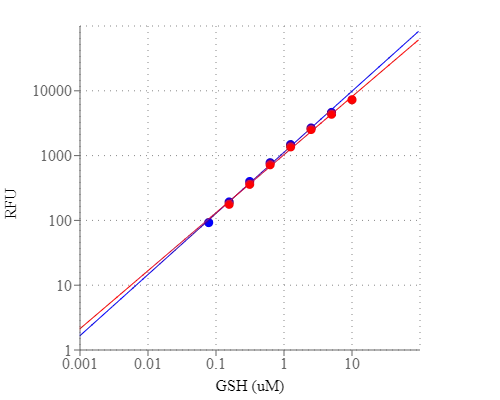
有很多试剂或检测试剂盒可用于定量生物系统中的硫醇。但是,大多数市场上的试剂盒都缺乏灵敏度或者含有繁琐操作。我们的Amplite?荧光谷胱甘肽GSH / GSSG比值分析试剂盒提供了一种超灵敏的分析方法,可定量分析样品中的GSH。该试剂盒使用专有的非荧光染料,与GSH反应后变为强荧光。使用一步荧光法,该试剂盒可在100μL测定体积(10 nM)中检测少至1皮摩尔的GSH或GSSG。该测定可以以在96孔或384孔微量滴定板下进行实验,并且容易适应自动化而无需分离步骤。其信号可通过荧光酶标仪在Ex / Em = 490 / 520nm处轻松读取。金畔生物是AAT Bioquest的中国代理商,为您提供最优质的Amplite 荧光法谷胱甘肽GSH/GSSG比率快速检测试剂盒。
适用仪器
| 荧光酶标仪 | |
| 激发: | 490nm |
| 发射: | 525nm |
| cutoff: | 515nm |
| 推荐孔板 | 黑色底板 |
产品说明书
96孔板测定示例(100个测试)
概述
1.准备Thiolite 绿色反应混合物(50μL)
2.添加GSH标准品和/或GSSG标准品或测试样品(50μL)
3.在室温下孵育10至60分钟监测Ex / Em = 490/520 nm处的荧光增加
注意:在开始实验之前,在室温下解冻所有试剂盒组分。
操作方法
1.准备GSH标准储备液:
将200μL测定缓冲液(组分B)加入到GSH标准品(组分C)的小瓶中以制备1mM(1nmol / L)GSH标准储备溶液。
注意:未使用的GSH标准储备溶液应分成单次使用的等分试样并储存在-20℃。
2.准备GSSG标准库存解决方案:
将200μlddH2O加入到GSSG标准品(组分F)的小瓶中以制备1mM(1nmol / L)GSSG标准储备溶液。
注意:未使用的GSSG标准储备溶液应分成单次使用的等分试样并储存在-20℃。
3.准备100X Thiolite Green原液:
将100μLDMSO(组分D)加入小瓶硫醇石绿(组分A)中以制备100X Thiolite™Green原液。
注意:未使用的Thiolite™Green原液应分成单次使用的等分试样,保存在-20℃,避免光照。
4.准备GSH分析混合物(GAM):
将100μL100XThiolite™Green原液(来自步骤3)加入10mL测定缓冲液(组分B)中,并通过涡旋充分混合。
注1:该GSH测定混合物(GAM)足以用于两个96孔板。在室温下不稳定,应在2小时内及时使用,避免暴露在光线下。
注2:或者,可以通过按比例添加含有分析缓冲液的100X Thiolite™Green原液来制备GSH分析混合物。
5.准备总GSH分析混合物(TGAM):
将5mL GAM(来自步骤4)加入GSSG探针(组分E)瓶中,并充分混合。
注1:该总GSH测定混合物(TGAM)足以用于一个96孔板。在室温下不稳定,应在2小时内及时使用,避免暴露在光线下。
注2:或者,可以通过向组分E的瓶中加入200μL的ddH2O制备25X GSSG探针,然后通过按比例混合储备溶液与GAM(来自步骤4)来制备TGAM测定混合物。将未使用的25X GSSG探针储备液等分并保存在-20℃,避免冻融循环。
6.准备连续稀释的GSH标准品(0至5μM):
6.1将10μL的GSH标准储备溶液(来自步骤1)加入到990L的测定缓冲液(组分B)中以产生10M(10pmol / L)GSH标准溶液。
注意:稀释的GSH标准溶液不稳定。 在4小时内使用。
6.2取200μL10μMGSH标准溶液进行1:2连续稀释,得到5,2.5,1.25,0.625,0.3125,0.1563,0.0781和0μM连续稀释的GSH标准品。
6.3如说明书中表1和表2所示,将GSH标准品和含有GSH的测试样品加入到96孔微量培养板中。当仅需要GSH测定时,根据表1仅填充左侧两列(A组)中的孔。跳过第7步,直接进入第8步。
注意:根据需要处理细胞或组织样本。
7.准备连续稀释的GSSG标准品(0至5μM):
7.1将10μLGSSG标准储备溶液(来自步骤2)加入990L测定缓冲液(组分B)中以产生10μM(10pmol / L)GSSG标准溶液。
注意:稀释的GSSG标准溶液不稳定。 在4小时内使用。
7.2取200μL10μMGSSG标准溶液进行1:2连续稀释,得到5,2.5,1.25,0.625,0.3125,0.1563,0.0781和0μM连续稀释的GSSG标准品。 总GSH标准溶液的浓度应为GSSG标准溶液浓度的两倍,分别为10,5,2.5,1.25,0.625,0.3125,0.1563和0μM。
7.3如说明书中表1和2所示,将GSSG标准品和含有GSH的测试样品加入到96孔微孔板中。当需要总GSH测定时,根据A组(左)和B组(右)填充孔。
注意:根据需要处理细胞或组织样本。
8.运行GSH和总GSH测定:
8.1将50μLGSHAssay Mixture(GAM,来自步骤4)加入GSH标准的A组(左),空白对照和测试样品(来自步骤6.3)的孔中,使总测定体积为100μL/孔。
注意:对于384孔板,每孔加入25μL样品和25μLGSHAssay混合液。
8.2如果需要总GSH(在还原和氧化状态下)测定,将50μL总GSH测定混合物(来自步骤5的TGAM)加入到GSSG标准,空白对照和测试样品的B组(右)的孔中(来自 步骤6.3)使总测定体积为100μL/孔。
注意:对于384孔板,每孔加入25μL样品和25μL总GSH分析混合物。
8.3在室温下孵育反应10分钟至1小时,避光。
8.4用荧光板读数器监测Ex / Em = 490 / 520nm处的荧光增加。
参考文献
ROS production and glutathione response in keratinocytes after application of β-carotene and VIS/NIR irradiation
Authors: Silke B Lohan, Kristina Vitt, Patrik Scholz, Cornelia M Keck, Martina C Meinke
Journal: Chemico-biological interactions (2017)
Osmotic stress is accompanied by protein glycation in Arabidopsis thaliana
Authors: Gagan Paudel, Tatiana Bilova, Rico Schmidt, Uta Greifenhagen, Robert Berger, Elena Tarakhovskaya, Stefanie Stöckhardt, Gerd Ulrich Balcke, Klaus Humbeck, Wolfgang Brandt
Journal: Journal of Experimental Botany (2016): 6283–6295
Systemic Induction of NO-, Redox-, and cGMP Signaling in the Pumpkin Extrafascicular Phloem upon Local Leaf Wounding
Authors: Frank Gaupels, Alexandra CU Furch, Matthias R Zimmermann, Faxing Chen, Volkhard Kaever, Anja Buhtz, Julia Kehr, Hakan Sarioglu, Karl-Heinz Kogel, Jörg Durner
Journal: Frontiers in plant science (2016)
Prediction of intracellular metabolic states from extracellular metabolomic data
Authors: Maike K Aurich, Giuseppe Paglia, Ottar Rolfsson, Sigrún Hrafnsdóttir, Manuela Magnúsdóttir, Magdalena M Stefaniak, Bernhard O Palsson, Ronan MT Fleming, Ines Thiele
Journal: Metabolomics (2015): 603–619
Molecular mechanisms of hyperthermia-induced apoptosis enhanced by withaferin A
Authors: Zheng-Guo Cui, Jin-Lan Piao, Mati UR Rehman, Ryohei Ogawa, Peng Li, Qing-Li Zhao, Takashi Kondo, Hidekuni Inadera
Journal: European journal of pharmacology (2014): 99–107
Cancer & Metabolism
Authors: Gregory LaMonte, Xiaohu Tang, Julia Ling-Yu Chen, Jianli Wu, Chien-Kuang Cornelia Ding, Melissa M Keenan, Carolyn Sangokoya, Hsiu-Ni Kung, Olga Ilkayeva, László G Boros
Journal: (2013)