上海金畔生物科技有限公司代理AAT Bioquest荧光染料全线产品,欢迎访问AAT Bioquest荧光染料官网了解更多信息。
Cell Meter 线粒体膜电位检测试剂盒 橙色荧光 适合流式细胞检测
 |
货号 | 22804 | 存储条件 | 在零下15度以下保存, 避免光照 |
| 规格 | 100 Tests | 价格 | 2604 | |
| Ex (nm) | 546 | Em (nm) | 575 | |
| 分子量 | 溶剂 | |||
| 产品详细介绍 | ||||
简要概述
Cell Meter 线粒体膜电位检测试剂盒是美国AAT Bioquest生产的用于线粒体膜电位检测的试剂盒,Cell Meter检测试剂盒是一类用于检测细胞功能的系列工具,包括细胞活性、细胞毒性、细胞凋亡、细胞膜电位以及细胞周期等方面的指标。每种检测方案均能提供不同荧光颜色的检测方案。这些高效的检测方案为从多角度研究细胞功能活动提供了一种十分有效的方法。Cell Meter线粒体膜电位检测试剂盒 *橙色荧光 适合流式细胞检测* 专门通过检测线粒体跨膜电势的减少来检测细胞凋亡。线粒体跨膜电势瓦解与线粒体渗透转运孔的开放相一致,导致细胞色素C释放到胞浆中,它是下游凋亡级联反应的触发器。该荧光实验方案利用我们独有的MitoLite Orange来检测凋亡细胞中线粒体跨膜电势的减少。在正常细胞中,当MitoLite Orange积聚于线粒体时,红色荧光增加。然而在凋亡细胞中,MitoLite Orange随着线粒体跨膜电位的塌陷而减少。被MitoLite Orange染色的细胞可以通过488n的激发光(FL2 通道)来观察。该试剂盒可以与其它Cell Meter检测试剂盒同时检测细胞的活性和凋亡,该试剂盒已被优化,可用于流式细胞法筛选凋亡激活剂或抑制剂。金畔生物是AAT Bioquest的中国代理商,为您提供最优质的Cell Meter 线粒体膜电位检测试剂盒。
适用仪器
| 流式细胞仪 | |
| 激发: | 488nm 或 532nm激发 |
| 发射: | 575/26nm滤波片 |
| 通道: | PE通道 |
产品说明书
样品实验方案
简要概述
1.用密度为5×105到1×106个细胞/ mL的测试化合物制备细胞
2.将2μL500XMitoTell Orange加入1 mL细胞溶液中
3.将细胞在37℃,5%CO2培养箱中孵育15-30分钟
4.将细胞沉淀,并将细胞重悬于1mL生长培养基中
5.使用具有FL2通道的流式细胞仪分析细胞
操作步骤
1.对于每个样品,将细胞制备在1 mL温热培养基或您选择的缓冲液中,密度为5×105至1×106个细胞/ mL。注意:应对每个细胞系进行单独评估,以确定诱导细胞凋亡的最佳细胞密度。
2.用测试化合物处理细胞一段所需的时间以诱导细胞凋亡,并建立平行对照实验。
3.对于阴性对照:仅用载体处理细胞。
4.对于阳性对照:使用FCCP或CCCP以5-50μM在37℃,5%CO2培养箱中处理细胞15至30分钟。注意:CCCP或FCCP可与MitoTell Orange同时添加。为了获得最佳结果,可能需要对每个单独的细胞系滴定CCCP或FCCP。
5.将2μL500XMitoTell 橙(组分A)加入处理过的细胞中。
6.将细胞在37℃,5%CO2培养箱中孵育15至30分钟。注意:对于粘附细胞,用0.5 mM EDTA轻轻提起细胞以保持细胞完整,并在用MitoTell Orange染料加载溶液孵育之前用含有血清的培养基洗涤细胞一次。
7.将细胞以1000rpm离心4分钟,然后将细胞重悬于1mL的分析缓冲液(组分B)或您选择的缓冲液中。
8.使用具有FL2通道(Ex / Em = 540 / 590nm)的流式细胞仪监测荧光强度。
数据分析
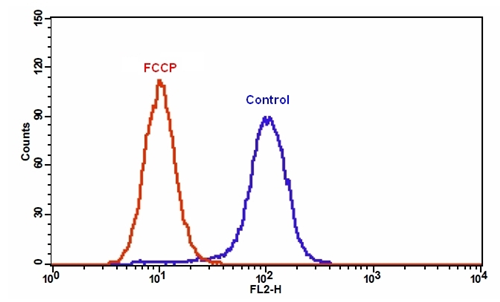
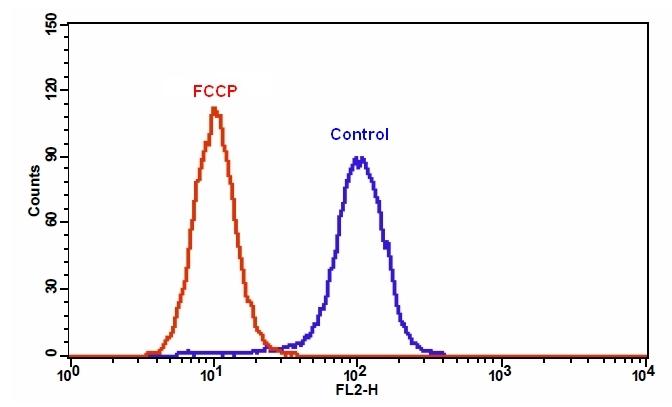
| 图1.在Jurkat细胞中添加FCCP后MitoTell Orange的荧光强度降低。 将Jurkat细胞单独加载MitoTell Orange(蓝色)或在30μMFCCP(红色)存在下加载15分钟。 使用FL2通道,用FACSCalibur(Becton Dickinson,San Jose,CA)流式细胞仪测量MitoTell Orange的荧光强度。 |
参考文献
Safranine O as a fluorescent probe for mitochondrial membrane potential studied on the single particle level and in suspension
Authors: Perevoshchikova IV, Sorochkina AI, Zorov DB, Antonenko YN.
Journal: Biochemistry (Mosc) (2009): 663
Computer-assisted live cell analysis of mitochondrial membrane potential, morphology and calcium handling
Authors: Koopman WJ, Distelmaier F, Esseling JJ, Smeitink JA, Willems PH.
Journal: Methods (2008): 304
Determination of high mitochondrial membrane potential in spermatozoa loaded with the mitochondrial probe 5,5′,6,6′-tetrachloro-1,1′,3,3′-tetraethylbenzimidazolyl-carbocyanine iodide (JC-1) by using fluorescence-activated flow cytometry
Authors: Guthrie HD, Welch GR.
Journal: Methods Mol Biol (2008): 89
Effects of eprosartan on mitochondrial membrane potential and H2O2 levels in leucocytes in hypertension
Authors: Labios M, Martinez M, Gabriel F, Guiral V, Ruiz-Aja S, Beltran B, Munoz A.
Journal: J Hum Hypertens (2008): 493
How DASPMI reveals mitochondrial membrane potential: fluorescence decay kinetics and steady-state anisotropy in living cells
Authors: Ramadass R, Bereiter-Hahn J.
Journal: Biophys J (2008): 4068
Life cell quantification of mitochondrial membrane potential at the single organelle level
Authors: Distelmaier F, Koopman WJ, Testa ER, de Jong AS, Swarts HG, Mayatepek E, Smeitink JA, Willems PH.
Journal: Cytometry A (2008): 129
Mitochondrial membrane potential in axons increases with local nerve growth factor or semaphorin signaling
Authors: Verburg J, Hollenbeck PJ.
Journal: J Neurosci (2008): 8306
The mitochondrial membrane potential and Ca2+ oscillations in smooth muscle
Authors: Chalmers S, McCarron JG.
Journal: J Cell Sci (2008): 75
[Evaluation of sperm mitochondrial membrane potential by JC-1 fluorescent staining and flow cytometry]
Authors: Xia XY, Wu YM, Hou BS, Yang B, Pan LJ, Shi YC, Jin BF, Shao Y, Cui YX, Huang YF.
Journal: Zhonghua Nan Ke Xue (2008): 135
Cyclosporin A-induced oxidative stress is not the consequence of an increase in mitochondrial membrane potential
Authors: van der Toorn M, Kauffman HF, van der Deen M, Slebos DJ, Koeter GH, Gans RO, Bakker SJ.
Journal: Febs J (2007): 3003
相关产品
| 产品名称 | 货号 |
| Cell Meter 线粒体膜电位检测试剂盒 红色荧光 适合流式细胞检测 | Cat#22806 |
| Cell Meter 线粒体膜电位检测试剂盒 橙色荧光 适合微孔板检测 | Cat#22805 |
| Cell Meter 线粒体膜电位检测试剂盒 红色荧光 适合微孔板检测 | Cat#22807 |