|
品牌:Enzo
CAS No.: 储存条件:-20℃ 纯度:– |
| 产品编号
(生产商编号) |
等级 | 规格 | 运输包装 | 零售价(RMB) | 库存情况 | 参考值 |
|
ALX-260-056-M001 |
– | 1 mg | – | 940.00 | – | – |
* 干冰运输、大包装及大批量的产品需酌情添加运输费用
* 零售价、促销产品折扣、运输费用、库存情况、产品及包装规格可能因各种原因有所变动,恕不另行通知,确切详情请联系上海金畔生物科技有限公司客服。
产品描述相关资料下载相关产品浏览记录 请联系客服

|
品牌:Enzo
CAS No.: 储存条件:-20℃ 纯度:– |
| 产品编号
(生产商编号) |
等级 | 规格 | 运输包装 | 零售价(RMB) | 库存情况 | 参考值 |
|
ALX-260-056-M001 |
– | 1 mg | – | 940.00 | – | – |
* 干冰运输、大包装及大批量的产品需酌情添加运输费用
* 零售价、促销产品折扣、运输费用、库存情况、产品及包装规格可能因各种原因有所变动,恕不另行通知,确切详情请联系上海金畔生物科技有限公司客服。
产品描述相关资料下载相关产品浏览记录 请联系客服
上海金畔生物科技有限公司代理AAT Bioquest荧光染料全线产品,欢迎访问AAT Bioquest荧光染料官网了解更多信息。
 |
货号 | 2554 | 存储条件 | 在2-8度冷藏保存, 避免光照 |
| 规格 | 1 mg | 价格 | 1008 | |
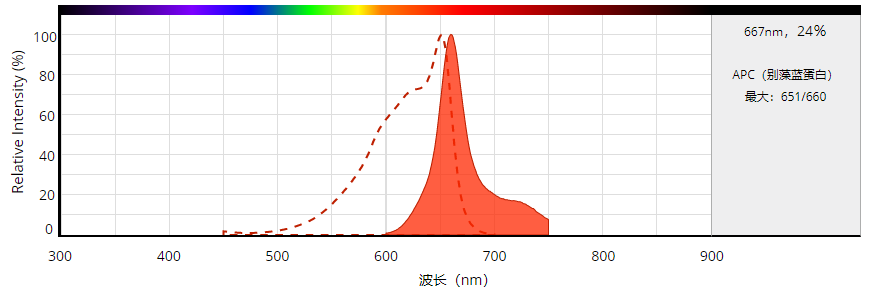
| Ex (nm) | 651 | Em (nm) | 660 | |
| 分子量 | ~105000 | 溶剂 | Water | |
| 产品详细介绍 | ||||
简要概述
产品基本信息
分子量:~105,000
Ex(nm):651
Ex(nm):662
荧光量子产率(QY):0.68
产品介绍
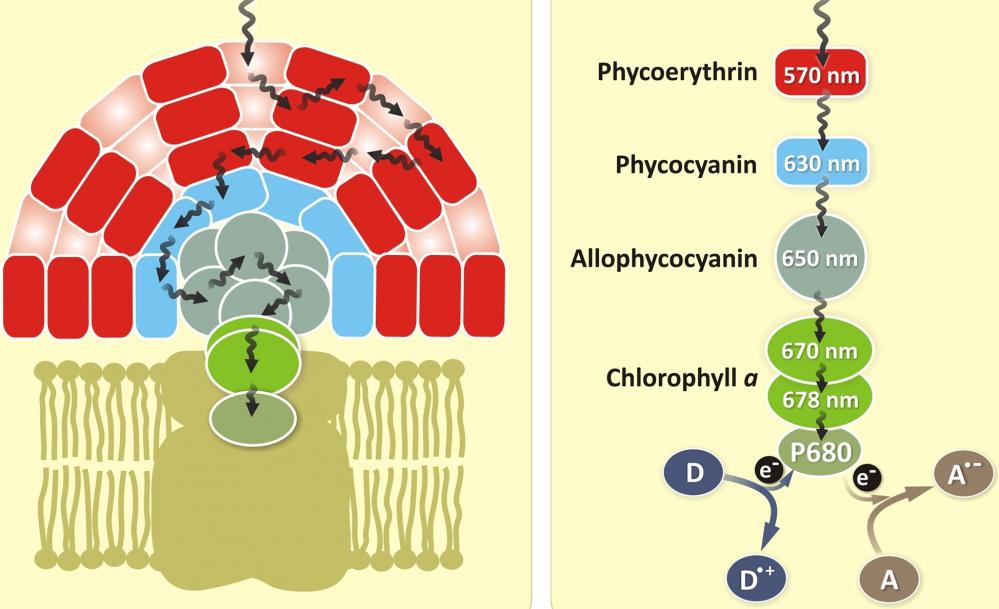
别藻蓝蛋白 APC是由藻胆蛋白提取出的一种荧光染料。藻胆蛋白由许多亚基组成,每个亚基具有蛋白质骨架,线性四吡咯发色团与其共价结合。藻红蛋白(红色)和藻蓝蛋白(蓝色)是两种主要的藻胆蛋白。藻红蛋白(PE)的吸收最大值介于490和570nm之间,而藻蓝蛋白(PC)的吸收最大值介于610和665nm之间。通常,当作为硫酸铵沉淀物冷藏储存时,藻胆蛋白具有良好的长期稳定性。纯化的胆脂蛋白可以在酸性或碱性条件下解离成亚基,但在室温下在中性pH下相对稳定,浓度大于0.1mg / mL。解离的亚基通常具有比天然色素更低的着色和荧光。建议将所有藻胆蛋白及其结合物(优选在中性缓冲溶液中)冷藏,从不冷冻。
藻胆蛋白[包括B-藻红蛋白(B-PE),R-藻红蛋白(R-PE)和别藻蓝蛋白(APC)]是用于生物学检测的超灵敏荧光染料。 它们比传统的有机荧光团灵敏度高100倍。 即使在诸如流式细胞术和免疫测定的实际应用中,藻胆蛋白缀合的抗体的灵敏度通常远大于相应的有机分子缀合物的灵敏度。 Phycobiliproteins是最亮的荧光标签,具有多个位点,可与许多生物和合成材料形成稳定的结合。
C-藻蓝蛋白(C-PC)在许多蓝细菌中作为主要的藻胆蛋白发生,在一些红藻中作为次生的藻胆蛋白发生。该颜料在615和620nm之间具有单个可见吸收最大值,在~650nm处具有最大荧光发射。其分子量在70,000至110,000道尔顿之间。颜料由两个亚基α和β组成,它们以相同的数量出现,但构成分子的α和β对的确切数目可能因物种而异。α和β亚基都仅含有PCB发色团。 除了直接吸收光之外,这种强烈的蓝色颜料通过荧光能量转移接受来自藻红蛋白的量子,其中存在PE的生物体。C-PC的红色荧光转移到别藻蓝蛋白。AAT Bioquest研发的RPE、APC试剂及试剂盒被国内外科研人员灵活运用,达到不俗的科研成果。
图示
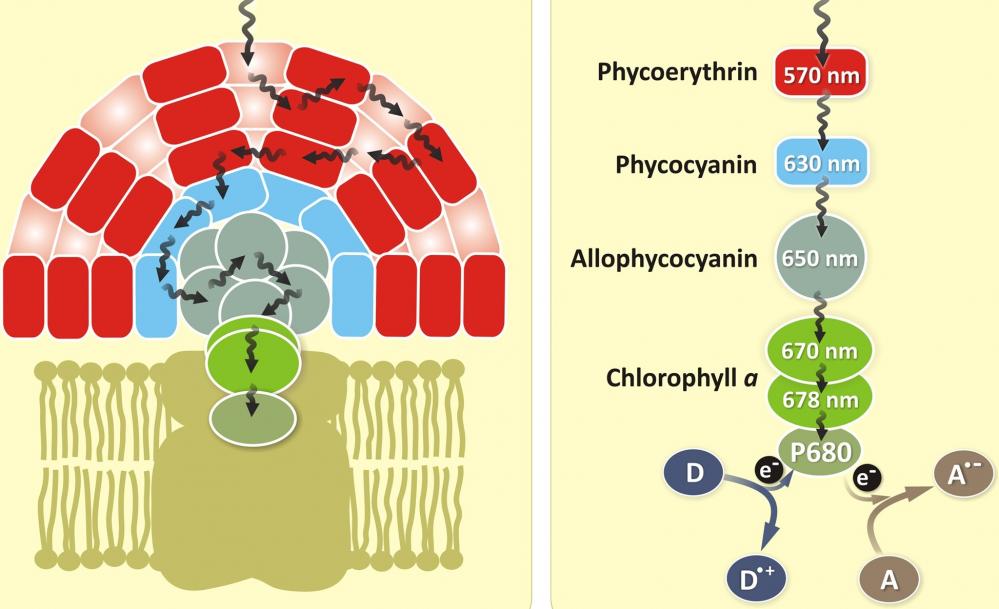
图1.藻蓝蛋白(APC)是一种与藻蓝蛋白,藻红蛋白和藻红蛋白同时存在的光采藻胆蛋白家族蛋白。 它是叶绿素的辅助色素。 所有藻胆蛋白都是水溶性的,因此不能像类胡萝卜素那样存在于膜内,而是聚集形成聚集在膜上的簇,称为藻胆体。 藻蓝蛋白吸收并发出红光,并且容易在蓝藻和红藻中发现。 藻胆素颜料具有出色的荧光特性,对于流式细胞仪的免疫测定非常有用。 |
点击查看光谱信息
参考文献
Chromophore attachment to phycobiliprotein beta-subunits: phycocyanobilin:cysteine-beta84 phycobiliprotein lyase activity of CpeS-like protein from Anabaena Sp. PCC7120
Authors: Zhao KH, Su P, Li J, Tu JM, Zhou M, Bubenzer C, Scheer H.
Journal: J Biol Chem (2006): 8573
Excitation energy transfer from phycobiliprotein to chlorophyll d in intact cells of Acaryochloris marina studied by time- and wavelength-resolved fluorescence spectroscopy
Authors: Petrasek Z, Schmitt FJ, Theiss C, Huyer J, Chen M, Larkum A, Eichler HJ, Kemnitz K, Eckert HJ.
Journal: Photochem Photobiol Sci (2005): 1016
Single-molecule spectroscopy selectively probes donor and acceptor chromophores in the phycobiliprotein allophycocyanin
Authors: Loos D, Cotlet M, De Schryver F, Habuchi S, Hofkens J.
Journal: Biophys J (2004): 2598
Evaluation of Tolypothrix germplasm for phycobiliprotein content
Authors: Prasanna R, Prasanna BM, Mohammadi SA, Singh PK.
Journal: Folia Microbiol (Praha) (2003): 59
Isolation and characterisation of phycobiliprotein rich mutant of cyanobacterium Synechocystis sp
Authors: Prasanna R, Dhar DW, Dominic TK, Tiwari ON, Singh PK.
Journal: Acta Biol Hung (2003): 113
Co-ordinated expression of phycobiliprotein operons in the chromatically adapting cyanobacterium Calothrix PCC 7601: a role for RcaD and RcaG
Authors: Noubir S, Luque I, Ochoa de Alda JA, Perewoska I, Tandeau de Marsac N, Cobley JG, Houmard J.
Journal: Mol Microbiol (2002): 749
Phycobiliprotein genes of the marine photosynthetic prokaryote Prochlorococcus: evidence for rapid evolution of genetic heterogeneity
Authors: Ting CS, Rocap G, King J, Chisholm SW.
Journal: Microbiology (2001): 3171
Novel activity of a phycobiliprotein lyase: both the attachment of phycocyanobilin and the isomerization to phycoviolobilin are catalyzed by the proteins PecE and PecF encoded by the phycoerythrocyanin operon
Authors: Zhao KH, Deng MG, Zheng M, Zhou M, Parbel A, Storf M, Meyer M, Strohmann B, Scheer H.
Journal: FEBS Lett (2000): 9
Phycobiliprotein-Fab conjugates as probes for single particle fluorescence imaging
Authors: Triantafilou K, Triantafilou M, Wilson KM.
Journal: Cytometry (2000): 226
[Phycobiliprotein and fluorescence immunological assay]
Authors: Wu P.
Journal: Sheng Li Ke Xue Jin Zhan (2000): 82

CM0287B
原厂型号
品牌
单件重量
货期
| ANTIBIOTIC MEDIUM NO.3(ASSAY B500GRAMS |
无参数

250ul 无色透明 ART自封闭吸头 预灭菌 96支/盒 10盒/包装
原厂型号
品牌
单件重量
货期
 |
无参数
|
品牌:Enzo
CAS No.: 储存条件:-20℃ 纯度:– |
| 产品编号
(生产商编号) |
等级 | 规格 | 运输包装 | 零售价(RMB) | 库存情况 | 参考值 |
|
BML-PI135-0001 |
– | 1 mg | – | 4,630.00 | – | – |
* 干冰运输、大包装及大批量的产品需酌情添加运输费用
* 零售价、促销产品折扣、运输费用、库存情况、产品及包装规格可能因各种原因有所变动,恕不另行通知,确切详情请联系上海金畔生物科技有限公司客服。
产品描述相关资料下载相关产品浏览记录 TNFα拮抗剂, 分子式: C19H37N5O5
分子量: 415.28
纯度: ≥99% (HPLC)