上海金畔生物科技有限公司代理AAT Bioquest荧光染料全线产品,欢迎访问AAT Bioquest荧光染料官网了解更多信息。
Amplite 荧光法蛋白酶体20S活性检测试剂盒 绿色荧光
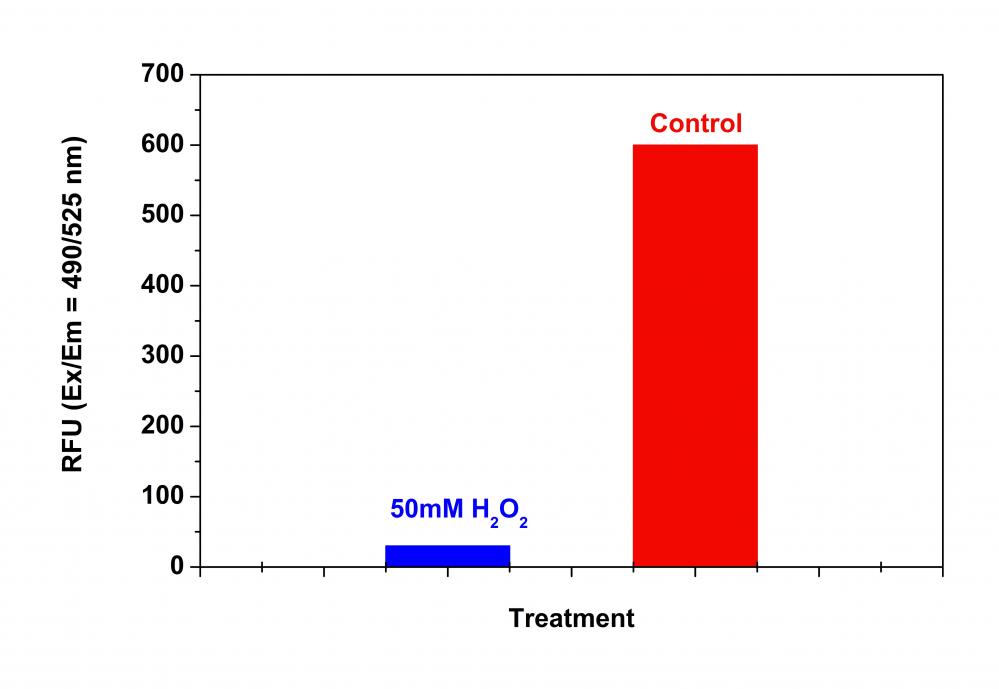 |
货号 | 13456 | 存储条件 | 在零下15度以下保存, 避免光照 |
| 规格 | 100 tests | 价格 | 3924 | |
| Ex (nm) | 500 | Em (nm) | 522 | |
| 分子量 | 溶剂 | |||
| 产品详细介绍 | ||||
简要概述
Amplite 荧光法蛋白酶体20S活性检测试剂盒 绿色荧光 是美国AAT Bioquest生产的蛋白酶检测试剂盒,蛋白酶体的主要功能是通过蛋白水解(一种破坏肽键的化学反应)降解不需要的或受损的蛋白质。蛋白酶体降解途径对于许多细胞过程是必不可少的,包括细胞周期,基因表达的调节和对氧化应激的反应。该途径中最常见的蛋白酶体形式是蛋白酶体26S,一种ATP依赖性蛋白水解复合物,其含有一个20S(700-kDa)核心颗粒结构和两个19S(700-kDa)调节帽。20S核心包含三种主要的蛋白水解活性,包括胰凝乳蛋白酶样,胰蛋白酶样和半胱天冬酶样活性。它负责细胞凋亡,DNA修复,内吞作用和细胞周期控制所涉及的关键蛋白的分解。
我们的Amplite 荧光蛋白酶体20S分析试剂盒是一种均相荧光分析,可测量与培养细胞中蛋白酶体复合物相关的胰凝乳蛋白酶样蛋白酶活性。该试剂盒使用LLVY-R110作为蛋白酶体活性的荧光指示剂。 蛋白酶体对LLVY-R110的切割产生强绿色荧光R110,其在520-530nm下荧光监测,激发波长为480-500nm。该试剂盒为所有必需组分提供优化的分析方案。该测定是稳定的,并且容易适用于高通量测定以评估蛋白酶体活性或筛选培养细胞或溶液中的抑制剂。可以以方便的96孔和384孔荧光微量滴定板形式进行测定。金畔生物是AAT Bioquest的中国代理商,为您提供最优质的Amplite 荧光法蛋白酶体20S活性检测试剂盒。
点击查看光谱
适用仪器
| 荧光酶标仪 | |
| 激发: | 490nm |
| 发射: | 525nm |
| cutoff: | 515nm |
| 推荐孔板: | 黑色孔板 |
| 使用模式: | 顶读模式 |
产品说明书
检测方案
概述
用测试化合物(100μL/孔/ 96孔板或25μL/孔/ 384孔板)
制备细胞加入等体积的蛋白酶体测定溶液(100μL/孔/ 96孔板或25μL/孔/ 384孔板)
在37°C或室温下孵育至少1小时
监测Ex / Em = 490 / 525nm处的荧光强度
操作方法
以下说明书仅提供指南,实际应根据您的具体需求进行修改。
1.准备细胞:
1.1对于粘附细胞:在生长培养基中以80,000个细胞/孔/ 90L将细胞过夜放置96孔板或对于384孔板放置20,000个细胞/孔/ 20L。
1.2对于非粘附细胞:从培养基中离心细胞,然后将细胞沉淀悬浮在培养基中,培养基为300,000细胞/孔/ 90L,用于96孔poly-D赖氨酸平板或80,000细胞/孔/ 20L用于培养384 -well poly-D赖氨酸板。 在实验之前,在制动器关闭的情况下以800rpm离心板2分钟。
注意:应对每个细胞系进行单独评估,以确定最佳细胞密度。
2.准备蛋白酶体测定加载溶液:
2.1使用前在室温下清洗所有试剂盒组件。
2.2制备400X蛋白酶体LLVY-R110底物储备溶液:将25μLDMSO(组分C)加入到蛋白酶体LLVY-R110底物(组分A)的小瓶中,并充分混合。
2.3制备蛋白酶体测定加载溶液:将25μL400X蛋白酶 LLVY-R110底物储备溶液(来自步骤2.2)加入10mL测定缓冲液(组分B)中,并充分混合。
注意:25μL400X蛋白酶体LLVY-R110底物储备液(来自步骤2.2)和10mL分析缓冲液(组分B)足以用于1个平板。 将未使用的400X 蛋白酶 LLVY-R110底物储备液和分析缓冲液等分并保存在-20℃,避免反复冻融循环。
3.运行蛋白酶体测定:
3.1用PBS或所需缓冲液中的10μL10X测试化合物(用于96孔板)或5μL5X测试化合物(用于384孔板)处理细胞。对于空白孔(没有细胞的培养基),加入相应量的化合物缓冲液。
3.2将细胞板在5%CO2,37℃培养箱中孵育一段所需的时间。
注意:纯蛋白酶体或细胞裂解液可直接用于筛选蛋白酶体抑制剂。
3.3加入100μL/孔(96孔板)或25μL/孔(384孔板)的蛋白酶体测定加载溶液(来自步骤2.3)。
3.4将板在37℃或室温下孵育至少1小时(2小时至过夜),避光。
注意:应对每个细胞系进行单独评估,以确定最佳孵育时间。
3.5在Ex / Em = 490 / 525nm处监测荧光强度(顶部读数)。
参考文献
Melatonin Promotes Ubiquitination of Phosphorylated Pro-Apoptotic Protein Bcl-2-Interacting Mediator of Cell Death-Extra Long (BimEL) in Porcine Granulosa Cells
Authors: Yingzheng Wang, Shenming Zeng
Journal: International journal of molecular sciences (2018): 3431
Mycobacterium tuberculosis Controls Phagosomal Acidification by Targeting CISH-Mediated Signaling
Authors: Christophe J Queval, Ok-Ryul Song, Jean-Philippe Carralot, Jean-Michel Saliou, Antonino Bongiovanni, Gaspard Deloison, Nathalie Deboosère, Samuel Jouny, Raffaella Iantomasi, Vincent Delorme
Journal: Cell Reports (2017): 3188–3198
Autophagy-mediated clearance of ubiquitinated mutant huntingtin by graphene oxide
Authors: Peipei Jin, Pengfei Wei, Yunjiao Zhang, Jun Lin, Rui Sha, Yi Hu, Jiqian Zhang, Wei Zhou, Han Yao, Li Ren
Journal: Nanoscale (2016)
Interactome analysis reveals a novel role for RAD6 in the regulation of proteasome activity and localization in response to DNA damage
Authors: Hongli An, Lu Yang, Chen Wang, Zhixue Gan, Haihui Gu, Tao Zhang, Xin Huang, Yan Liu, Yufeng Li, Shing-Jyh Chang
Journal: Molecular and Cellular Biology (2016): MCB–00419
L-BMAA induced ER stress and enhanced caspase 12 cleavage in human neuroblastoma SH-SY5Y cells at low nonexcitotoxic concentrations
Authors: Oliver Okle, Kerstin Stemmer, Ulrich Deschl, Daniel R Dietrich
Journal: toxicological sciences (2013): 217–224
