上海金畔生物科技有限公司代理AAT Bioquest荧光染料全线产品,欢迎访问AAT Bioquest荧光染料官网了解更多信息。
钙离子荧光探针Cal-630 AM
 |
货号 | 20532 | 存储条件 | 在零下15度以下保存, 避免光照 |
| 规格 | 1 mg | 价格 | 9216 | |
| Ex (nm) | 609 | Em (nm) | 626 | |
| 分子量 | 1282.89 | 溶剂 | DMSO | |
| 产品详细介绍 | ||||
简要概述
钙离子荧光探针Cal-630 AM是美国AAT Bioquest生产的钙离子荧光探针,Calbryte 520,Calbryte 590和Calbryte 630提供最强大的均匀荧光测定工具,用于检测细胞内钙动员。与现有的钙指示剂(如Fluo-3 AM,Fluo-4 AM和Rhod-2 AM)相比,这些钙敏感染料明显更亮,并提供更高的信噪比,大大提高了细胞内保留和负载效率。表达通过钙发出信号的GPCR或钙通道的细胞可以预装载可以穿过细胞膜的Calbryte 520 AM,Calbryte 590 AM或Calbryte 630 AM。一旦进入细胞内,Cal520 AM,Calbryte 590 AM或Calbryte 630 AM的亲脂性阻断AM基团被细胞内酯酶切割,产生带负电荷的荧光Calbryte 染料,留在细胞内。它们与钙结合后的荧光大大增强。当用激动剂刺激细胞时,该受体表示细胞内钙的释放,这显着增加了Calbryte 520,Calbryte 590或Calbryte 630的荧光。高灵敏度和> 100倍荧光增强的特性使Calbryte 520 AM, Calbryte 590 AM或Calbryte 630 AM是测量细胞内钙的最强大指标。
除了方便的激发波长和钙的大荧光增强外,Calbryte 520,Calbryte 590和Calbryte 630主要定位于细胞溶胶中,不像Rhod-2主要位于线粒体中。 此外,Calbryte 590和Calbryte 630的长Ex / Em波长使这些染料成为完美的钙指示剂,可与绿色荧光蛋白(GFP)细胞系进行多色检测。 此外,Calbryte 520,Calbryte 590或Calbryte 630钙测定经过优化,可与大多数现有荧光仪器兼容。 Calbryte 520可在488 nm处激发,并与FITC滤光片组配合使用。 Calbryte 590经过优化,可在555 nm激发,并与TRITC / Cy3滤光片组配合使用。 Calbryte 630经过优化,可在594 nm激发,并与TexasRed®滤光片组配合使用。金畔生物是AAT Bioquest的中国代理商,为您提供最优质的钙离子荧光探针。
钙离子篇:时间轴式讲解应用于钙离子检测的探针
适用仪器
| 荧光显微镜 | |
| 激发: | Texas Red |
| 发射: | Texas Red |
| 推荐孔板: | 黑色透明 |
| 荧光酶标仪 | |
| 激发: | 600nm |
| 发射: | 640nm |
| cutoff: | 630nm |
| 推荐孔板: | 黑色透明 |
| 读取模式: | 底读模式 |
产品说明书
使用Calbryte 520 AM,Calbryte 590 AM或Calbryte 630 AM酯类
1.操作步骤
Calbryte AM酯应在使用前在无水DMSO中重新配制。 DMSO储备溶液可以在-20℃下储存(干燥)并避光。 在这些条件下,AM酯应稳定三个月。 以下是我们推荐的将Calbryte 520 AM,Calbryte 590 AM或Calbryte 630 AM酯加入活细胞的方案。 该方案仅提供指南,实际应根据您的特定需求进行修改。
a)在无水DMSO中制备2至5mM Calbryte 520AM,Calbryte 590AM或Calbryte 630AM酯的储备溶液。
b)将Calbryte 520 AM,Calbryte 590 AM或Calbryte 630 AM溶解在DMSO中或将等份的指示剂储备溶液解冻至室温。 在Hanks和Hepes缓冲液(HHBS)或您选择的缓冲液(0.04%Pluronic®F-127)中制备10至20μM的染料工作溶液。 细胞加载所需指示剂的确切浓度必须根据经验确定。
注意:非离子型洗涤剂Pluronic®F-127有时用于增加Calbryte 520 AM,Calbryte 590 AM或Calbryte 630 AM酯的水溶性。 各种Pluronic®F-127可从金畔购买。
c)如果您的细胞(如CHO细胞)含有有机阴离子转运蛋白,可将丙磺舒(1-2 mM)添加到染料工作溶液中(最终浓度为0.5-1 mM)
注意:各种ReadiUse 丙磺舒(包括水溶性钠盐和稳定溶液)均可从金畔购买。
d)将等体积的染料工作溶液(来自步骤b或c)加入细胞板中。
e)将染料加载板在细胞培养箱中孵育约60分钟,然后将板在室温下再孵育15分钟。
f)用HHBS或您选择的含有阴离子转运蛋白抑制剂(如1 mM丙磺舒)的缓冲液替换染料工作溶液,以去除多余的探针。
g)对于Calbryte 520 AM,在Ex / Em = 490 / 525nm处进行钙测试,对于Calbryte 590 AM,使用540/590nm进行钙测试,对于Calbryte 630 AM,使用610/640nm进行钙测试。
2.测量细胞内钙响应
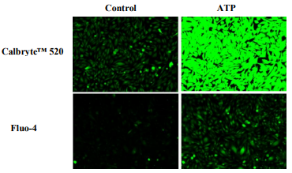
图1. CHO-K1细胞中内源性P2Y受体对ATP的反应。 将CHO-K1细胞以每孔100μL每孔40,000个细胞接种过夜,在96孔黑色壁/透明底板中。 将含有丙磺舒的HHBS中的100μLFluo-4AM或Calbryte 520AM加入孔中,并将细胞在37℃下孵育45分钟。 用200μLHHBS替换染料加载培养基,加入50μL50μMATP,并使用FITC通道用荧光显微镜(Keyence)成像。
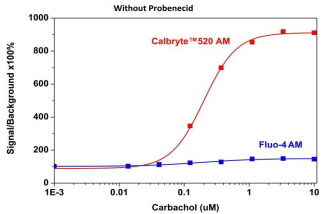
图2.用Calbryte 520或Fluo-4 AM测量的CHO-M1细胞中外源M1受体的卡巴胆碱刺激的钙响应。 在96孔黑壁/透明底板中,将CHO-M1细胞以每100μL/孔40,000个细胞接种过夜。 将100μLFluo-4AM或不含丙磺舒的Calbryte 520AM加入细胞中,并将细胞在37℃下孵育45分钟。 通过FlexStation 3(Molecular Devices)添加Carbachol(50μL/孔)以达到最终指示的浓度。
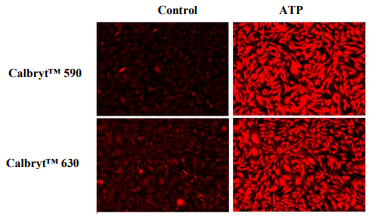
图3. CHO-K细胞中内源性P2Y受体对ATP的反应。 在96孔黑壁/透明底板中,将CHO-K细胞以每100μL/孔40,000个细胞接种过夜。 将100μL具有2mM丙磺舒的HbBS中的Calbryte 590AM或Calbryte 630 AM加入孔中,并将细胞在37℃下孵育1小时。 将染料加载培养基替换为200μLHHBS,用50μL50μMATP处理,并使用TRITC通道(Calbryte 590)和Texas Red Channel(Calbryte 630)用荧光显微镜(Keyence)成像。
结论
由于Ca 2+在生物学中的重要性,已经建立了许多用于分析细胞和/或亚细胞Ca 2+活性机制的技术/方法。 尽管用于分析Ca 2+活性的每种方法都具有优于其他方法的某些优点,但每种方法也存在缺点。 凭借上述出色的性能,我们相信Calbryte 520,Calbryte 590和Calbryte 630钙检测试剂为各种生物系统中的细胞内钙分析和监测提供了新的强大工具。
正如可能预测的那样,Ca2 +分析中许多研究人员的兴趣从细胞水平转移到亚细胞水平。 已经发现Ca2 +在整个细胞中均匀分布,并且在多种细胞(例如,卵母细胞,心肌细胞,肝细胞和外分泌细胞)中观察到Ca2 +的细胞内异质性(例如Ca2+ waves and Ca2+ sparks)。 随着20世纪80年代共聚焦激光扫描显微镜(CLSM)和2000年代先进的酶标仪(如FLIPR,FDSS和NOVOStar专用于细胞内Ca2 +检测)的出现,细胞内Ca2 +的测量显着加速。 共聚焦激光扫描显微镜和最近的多光子显微镜除了测量其浓度外,还允许在亚细胞水平上对细胞内Ca 2+信号传导进行精确的空间和时间分析。
参考文献
Behavioral role of the reciprocal inhibition between a pair of Mauthner cells during fast escapes in zebrafish
Authors: Takashi Shimazaki, Masashi Tanimoto, Yoichi Oda, Shin-ichi Higashijima
Journal: Journal of Neuroscience (2019): 1182–1194
Deep Two-Photon Imaging In Vivo with a Red-Shifted Calcium Indicator
Authors: Antje Birkner, Arthur Konnerth
Journal: (2019): 15–26
In Vivo Functional Mapping of a Cortical Column at Single-Neuron Resolution
Authors: Carsten H Tischbirek, Takahiro Noda, Manabu Tohmi, Antje Birkner, Israel Nelken, Arthur Konnerth
Journal: Cell reports (2019): 1319–1326
Multiplex imaging of quantal glutamate release and presynaptic Ca2+ at multiple synapses in situ
Authors: Thomas P Jensen, Kaiyu Zheng, Nicholas Cole, Jonathan S Marvin, Loren L Looger, Dmitri A Rusakov
Journal: bioRxiv (2019): 336891
Multiplex imaging relates quantal glutamate release to presynaptic Ca 2+ homeostasis at multiple synapses in situ
Authors: Thomas P Jensen, Kaiyu Zheng, Nicholas Cole, Jonathan S Marvin, Loren L Looger, Dmitri A Rusakov
Journal: Nature Communications (2019): 1414
A 3D human triculture system modeling neurodegeneration and neuroinflammation in Alzheimer’s disease
Authors: Joseph Park, Isaac Wetzel, Ian Marriott, Didier Dréau, Carla D’Avanzo, Doo Yeon Kim, Rudolph E Tanzi, Hansang Cho
Journal: Nature neuroscience (2018): 941
Concepts of All-Optical Physiology
Authors: Jan Doering, Ting Fu, Isabelle Arnoux, Albrecht Stroh
Journal: (2018): 153–174
Optical probes for neurobiological sensing and imaging
Authors: Eric H Kim, Gregory Chin, Guoxin Rong, Kira E Poskanzer, Heather A Clark
Journal: Accounts of chemical research (2018): 1023–1032
Optogenetic Control of Voltage-Gated Calcium Channels
Authors: Guolin Ma, Jindou Liu, Yuepeng Ke, Xin Liu, Minyong Li, Fen Wang, Gang Han, Yun Huang, Youjun Wang, Yubin Zhou
Journal: Angewandte Chemie International Edition (2018): 7019–7022
α V β 3 Integrin regulates astrocyte reactivity
Authors: Raúl Lagos-Cabré, Alvaro Alvarez, Milene Kong, Francesca Burgos-Bravo, Areli Cárdenas, Edgardo Rojas-Mancilla, Ramón Pérez-Nunez, Rodrigo Herrera-Molina, Fabiola Rojas, Pascal Schneider
Journal: Journal of Neuroinflammation (2017): 194
